gga-miR-155对MDCC-MSB1细胞转录组的影响
余祖华,贾艳艳,何 雷,廖成水,李 静,魏 颖,陈 建,陈松彪,尚 珂,丁 轲*
(1.洛阳活载体生物材料与动物疫病重点实验室,洛阳 471003;
2.河南科技大学功能微生物与畜禽健康实验室,洛阳 471003;
3.河南科技大学动物科技学院,洛阳 471003)
microRNA(miRNA)是一类内源性小分子非编码RNA(noncoding RNAs, ncRNAs),成熟miRNA长度为22~25个核苷酸(nt),是迄今为止研究最充分的一类ncRNAs[1]。miRNAs与Argonaute (AGO)蛋白形成RNA诱导沉默复合体 (RISC),通过其5′端6~8个核苷酸的种子序列与靶mRNA的3′UTR互补结合,导致mRNA降解和/或翻译抑制,在转录后表达调控中起着关键作用[2]。据估计,miRNA约占细胞总RNA的0.02%,并在转录后调节超过60%的编码基因[3],每个miRNA可以识别和抑制多种靶mRNA,而其表达的增加或减少最终可能导致细胞基因表达谱的全面改变,从而参与生物体内包括细胞的增殖与分化、新陈代谢、免疫应答、疾病的发生和肿瘤的形成等几乎所有的生物学过程。
马立克病(Marek’s disease,MD)是由血清Ⅰ型马立克病病毒(Marek’s disease virus,MDV)感染鸡后引起的一种以CD4+T淋巴细胞增生为主要特征的肿瘤性、免疫抑制性传染病。虽然MDV诱导肿瘤的发生可以用病毒疫苗较好地预防,但伴随着病毒自身进化及疫苗免疫压力,目前,MDV流行毒株的毒力正不断增强[4],因此MD肿瘤发生发展的机制和有效防控仍是该病研究的重要方向。近年来研究表明,miRNA在MD肿瘤发生中发挥重要的调控作用[5-6],其中,miR-155的功能性同源体MDV-miR-M4在MDV致瘤作用中发挥重要的调控作用[7-9]。miR-155是一种保守的多功能miRNA,研究表明miR-155在机体的造血、免疫、炎症、肿瘤等多项生命活动中发挥重要的调控作用[10-12]。近年来研究表明,miR-155在CD4+T细胞功能中起着至关重要的作用,其可通过靶基因对CD4+T细胞免疫方面以及免疫抑制性疾病发挥了重要调控作用,可作为一个潜在的疾病生物标志物和治疗的目标[13]。余祖华等[14]研究发现,gga-miR-155可促进MDV转化的肿瘤细胞系MDCC-MSB1细胞的增殖、抑制其凋亡,但其具体的调控机制仍需进一步地探讨。因此,为了更好地了解 gga-miR-155在MD肿瘤发生中可能的作用,本研究以MDV转化的肿瘤细胞系MDCC-MSB1为模型,在过表gga-miR-155的基础上,使用高通量测序分析过表达gga-miR-155的MDCC-MSB1细胞转录组的变化,旨在揭示gga-miR-155调控的 mRNA 转录物,以探讨gga-miR-155在MD肿瘤发生中的作用机制,为MD的防控研究提供新思路。
1.1 材料
1.1.1 主要试剂和耗材 RPMI 1640 培养基、胎牛血清(FBS)、Penicillin-Streptomycin Solution均购自 Gibco 公司;
转染试剂riboFECTTMCP 购自广州锐博生物科技有限公司、总RNA提取试剂盒TPK-1001购自联川生物科技有限公司;
PrimeScriptTMRT reagent Kit、TB Green®Premix Ex TaqTMII购自Takara公司;
胰蛋白胨磷酸肉汤(TPB)购自Sigma 公司;
6孔细胞板、25 cm2细胞瓶、离心管等购自Corning公司。
1.1.2 细胞 马立克氏病毒转化的肿瘤细胞系MDCC-MSB1为本实验室保存。
1.1.3 主要仪器 ABI7900荧光定量PCR仪 (美国ABI公司),CO2恒温培养箱(日本Sanyo公司),倒置荧光显微镜、倒置显微镜(日本Olympus公司),NanoDrop ND-2000超微量核酸蛋白测定仪(美国Thermo公司), Agilent 2100 生物分析仪(美国Agilent公司),分光光度计等。
1.2 gga-miR-155模拟物及荧光定量引物的合成
1.2.1 gga-miR-155模拟物的合成 根据miRBase数据库中gga-miR-155成熟体序列委托广州锐博生物科技有限公司合成gga-miR-155模拟物(5′-UUAAUGCUAAUCGUGAUAGGGG-3′)及其阴性对照(5′-UUCUCCGAACGUGUCACGUTT-3′)。
1.2.2 荧光定量引物的设计与合成 根据文献[6]设计合成gga-miR-155和U6的颈环荧光定量PCR 扩增引物以及随机抽取的差异表达基因的荧光定量PCR(表1),引物送往生工生物工程(上海)有限公司合成。

表1 Real-time PCR引物序列
1.3 细胞培养
MDCC-MSB1细胞采用含有10%FBS、1% (Penicillin-Streptomycin Solution)和10% TPB的 RPMI1640 培养基,置于5% CO2、37 ℃恒温培养箱培养。
1.4 试验分组和细胞瞬时转染
将3×105个·mL-1处于对数生长期、生长状态良好的MDCC-MSB1细胞悬液接种于6孔细胞板,每孔1 mL细胞悬液。试验分为2组,一组为gga-miR-155模拟物转染组,另一组为gga-miR-155模拟物阴性对照转染组,每组3个重复。根据riboFECTTMCP转染试剂操作说明进行转染,在转染后48 h收集细胞进行相关检测。
1.5 RNA提取及检测
于转染后48 h收集gga-miR-155模拟物及其阴性对照转染组的细胞,用总RNA提取试剂盒TPK-1001提取细胞总 RNA,将每组3个重复的样本分别命名为M1、M2、M3和C1、C2、C3。Nanodrop-1000核酸蛋白测定仪测定总RNA的浓度和纯度, 用Agilent 2100 生物分析仪检测RNA质量。
1.6 实时荧光定量PCR
按照文献[9]方法,定量并分析、比较转染后48 h gga-miR-155模拟物及其阴性对照转染组中gga-miR-155相对表达量的差异。
1.7 测序文库的构建及高通量测序
质量合格的gga-miR-155模拟物及其阴性对照转染组细胞总 RNA,用Ribo-ZeroTMGold Kits 去除样品中的 rRNA, 富集mRNA后将其片段化,用随机引物合成第1条cDNA链,再合成第2条cDNA链。双链产物经纯化、平末端修复、加接头和poly(A)尾,选择片段后进行PCR扩增,获得测序文库。文库质检合格后采用Illumina NovaseqTM6000平台进行测序分析。
1.8 测序数据分析
6个样品(分别为M1、M2、M3和C1、C2、C3)构建的测序文库所得的原始数据经过滤(去除带接头的序列、含有5%以上无法确定碱基信息的序列及质量值Q10的碱基数占整个read的20%以上低质量的序列),得到纯净序列(clean reads),计算过滤后每个测序文库的Phred值(Q20、Q30)和GC含量。应用TopHat v2.0.9和Scripture(Beta2)对所得的clean reads在鸡参考基因组进行比对和定位,利用HTSeq(v0.5.3)软件进行基因表达水平分析,根据FPKM (fragments per kilobase of transcript sequence per milions base pairs sequenced)计算每个基因的表达量。采用DESeq2软件对试验组和对照组细胞的基因表达差异进行分析,筛选标准为log2Fold Change≥1且校正后的P<0.05。分别利用 GO seq(v2.12)软件和KOBAS(v2.0)软件对获得的差异表达基因进行GO富集分析和KEGG 通路富集分析,采用超几何分布检验的方法计算每个通路条目中差异基因富集的显著性。最后,通过 TargetScan(v. 5.0)和 miRanda(v. 3.3a)预测与gga-miR-155具有靶标关系的mRNA,获得较为可信的靶基因。
1.9 转录组测序结果的实时荧光定量PCR验证
为验证转录组测序结果,本研究以GAPDH作为内参,采用qRT-PCR检测gga-miR-155过表达组与对照组中IDH1、FGL2、RAC2、BACH1、HSPD1和TAF11等6个差异表达基因的表达量。利用Primer Premier 5.0软件进行引物设计,引物相关信息见表1。取gga-miR-155模拟物及其阴性对照转染组的细胞样品,利用1.4方法提取总RNA后,按照PrimeScriptTMRT reagent Kit将RNA逆转录为cDNA。然后使用TB Green®Premix Ex TaqTMII和表1中基因特异性引物在ABI7900荧光定量PCR仪上进行实时荧光定量PCR,采用2-△△Ct法计算基因的相对表达量。
1.10 统计学方法
2.1 gga-miR-155在MDCC-MSB1细胞中的表达检测
采用qPCR检测gga-miR-155是否在MDCC-MSB1中实现过表达。由图1可知,gga-miR-155模拟物转染组表达量为(11.512±0.896),gga-miR-155模拟物NC转染组的表达量为(0.948±0.054),gga-miR-155模拟物转染组中gga-miR-155的表达量极显著的高于gga-miR-155模拟物NC转染组(P<0.01)。

**.P<0.01
2.2 RNA样本检测
采用Nanodrop-1000核酸蛋白测定仪和Agilent 2100 生物分析仪检测总RNA质量。结果可知,OD260 nm/OD280 nm值在1.91~2.04之间,28S/18S≥1,在1.4~2之间, RIN 值≥7,在9.2~9.7之间(表2),表明提取的各组总RNA完整性好,质量符合要求,样品可进行高通量测序。

表2 RNA样本检测
2.3 转录组测序质量评估
通过去除tRNA法构建文库,并进行Illumina NovaseqTM6000测序,gga-miR-155模拟物转染组M1、M2、M3文库分别获得78 879 880亿、105 580 002亿、110 695 196亿条raw reads,过滤后分别获得77 655 222亿、103 485 920亿、108 478 966亿条clean reads,序列有效率分别为98.45%、98.02%、98%,GC含量分别为 49.5%、49%、49%;
对照组C1、C2、C3文库分别90 571 206亿、79 318 188亿、101 493 076亿条raw reads,过滤后分别获得88 803 092亿、77 829 620亿、99 572 012亿条clean reads,GC含量分别为 49.5%、50%、49.5%。平均Q20>99%,Q30>93%,表明数据质量较高,可用于后续差异基因分析。
2.4 gga-miR-155模拟物转染后MDCC-MSB1细胞差异基因表达的筛选
gga-miR-155模拟物转染组与对照组检测到共有表达基因13 833个,其中,gga-miR-155模拟物转染组特有基因1 321个,对照组特有基因791个(图2A)。对gga-miR-155模拟物转染组与对照组中上调与下调的显著性差异表达mRNA进行数目统计,并用火山图展示,横坐标(log2Fold Change)表示基因在不同样本中的差异倍数,纵坐标(-lgPval)表示表达差异的显著性水平,红色点表示显著上调基因,蓝色点表示显著下调基因。gga-miR-155模拟物转染组和对照组相比,共有87个差异表达基因,其中,有47个基因上调,40个基因下调(图2B、C)。

A.表达基因韦恩图;
B.差异表达基因火山图;
C.差异表达基因层次聚类热图
2.5 差异表达基因的GO分类与富集分析
对87个差异表达基因(DEG)进行GO功能分类,结果如图3所示。在GO功能分析中,生物学过程(biological process)25条,细胞组分(cellular component)有15条,分子功能(molecular function)有10条。在生物学过程里,显著富集程度排在前4的分别为新陈代谢过程(metabolic process)、转录调节(regulation of transcription)、氧化还原过程(oxidation-reduction process)和细胞内蛋白运输(intracellular protein transport)。在细胞组分里,显著富集程度排在前4的分别为细胞质(cytoplasm)、核(nucleus)、膜(membrane)和胞外外泌体(extracellular exosome)。在分子功能里,显著富集程度排在前3的分别为蛋白结合(protein binding)、ATP结合(ATP binding)和蛋白同源化活性(protein homodimerization activity)。功能富集分析显示,代谢过程和蛋白结合有关的差异基因占比较大。
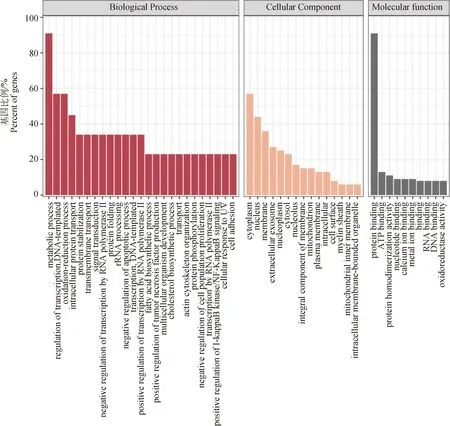
图3 差异表达基因GO功能富集
2.6 差异表达基因的KEGG富集分析
对87个差异表达基因进行KEGG 通路功能注释并进行显著性富集,结果显示共得到20条显著富集的KEGG信号通路。其中主要与真核生物核糖生物合成、吞噬体、嘧啶代谢、碳代谢、氨基酸代谢、类固醇生物合成等信号通路有关(图4),这些富集结果表明差异表达的 mRNA 与MDCC-MSB1细胞代谢是密不可分的。

圆圈的颜色表示每个信号通路相应的显著性P值,圆圈大小表示每个信号通路上出现的差异基因数
2.7 转录组测序结果的实时荧光定量PCR验证
选取了IDH1、FGL2、RAC2、BACH1、HSPD1和TAF11等6个差异表达基因qRT-PCR验证结果显示,所选择的差异表达基因qRT-PCR结果和转录组测序结果上调和下调表达趋势相同(图5,表3),表明转录组测序筛选的差异基因是可信的。

*.P<0.05, **.P<0.01

表3 选取的差异表达基因的转录组测序结果
2.8 低表达基因与gga-miR-155的靶关系分析
针对转录组测序结果,筛选gga-miR-155模拟物组表达量显著下调且与代谢相关的候选基因,通过Targetscan和miRada软件共同对测序低表达基因结果进行 gga-miR-155的靶基因预测,结果显示鸡BACH1基因为符合条件的直接靶基因,TargetScan预测gga-miR-155靶向结合BACH1 3′UTR的种子区(589—596位),如图6所示。

图6 gga-miR-155的靶基因预测
在肿瘤发生发展过程中涉及多种分子的调控,研究表明,miRNA水平的失调与肿瘤发生有关,越来越多的miRNA被证实对肿瘤的发生有重要影响,肿瘤细胞的增殖、分化、凋亡、转移等多种生物学过程都与miRNA 密不可分[15-16]。因此,miRNA对肿瘤的调控作用仍是学术界研究的热点之一,详细了解miRNAs在肿瘤发生中的调节机制对于理解其生理作用至关重要。
有研究报道在肿瘤发生发展过程中,miRNA-155可作为癌基因或抑癌基因,通过调控细胞的侵袭与迁移来影响肿瘤转移,miRNA-155已被认为是许多肿瘤性疾病的标记物[17]。miRNA作为转录后调控表观变化的关键因子,在基因调控网络中发挥重要的协作作用[18]。通过表达载体或使用合成miRNA模拟物过表达miRNA,然后通过mRNA微阵列或RNA测序(RNA-seq)对基因表达变化进行高通量分析,可以直接评估目标基因。为了探究gga-miR-155在MD肿瘤发生中可能参与的调控作用,本研究中通过在MDCC-MSB1细胞中过表达gga-miR-155后进行转录组测序,以期筛选到gga-miR-155直接或间接调控的基因,结果显示,在MDCC-MSB1细胞中过表达gga-miR-155后筛选到87个有差异表达的基因。由于MiRNAs是作用到相应靶基因的3′-UTR的种子序列区而发挥相应的调控作用,每个miRNA可以调控多个靶基因,每个特定的靶基因可以同时被多个miRNA所调控, Baek等[2]发现过表达miRNA对内源蛋白的抑制率一般小于50%。单一miRNA的过表达可能无法导致某一靶基因转录和蛋白水平的过度波动[19],这可能是本研究中筛选得到的差异表达基因没有其他类似研究[20- 21]多的主要原因。
肿瘤的形成是一个多步骤过程,在这一过程中获得了多个特征,细胞内能量代谢异常是肿瘤的十大重要特征之一,miRNA可能通过调节有氧糖酵解相关酶的表达来介导有氧糖酵解,从而调控肿瘤细胞代谢和增殖[22]。核糖体负责细胞内蛋白质的合成,研究表明核糖体生物发生的异常与肿瘤性的发生发展密切相关[23]。本研究中差异基因的GO功能富集分析结果显示,有很多差异蛋白主要与代谢过程和蛋白结合有关。差异表达基因的KEGG信号通路富集结果显示,差异表达基因与真核生物核糖生物合成、吞噬体、嘧啶代谢、碳代谢、氨基酸代谢、类固醇生物合成等信号通路有关,表明gga-miR-155参与调控的与代谢和蛋白结合有关的基因会引起这些代谢调节通路的异常,从而与肿瘤的发生发展有关。
BACH1是一种转录抑制因子,在哺乳动物组织中广泛表达,已有大量研究证实BACH1是一个促肿瘤转移因子,高表达的BACH1提高了乳腺癌、食管癌、结直肠癌等细胞的迁移活性[24]。近年研究发现BACH1参与肿瘤代谢重编程,促进肿瘤血管和淋巴管的新生和重构,从而增强肿瘤细胞的侵袭转移[25-26]。在三阴性乳腺癌中,BACH1高表达能靶向线粒体代谢,降低三羧酸循环中的葡萄糖利用率,负调节电子传递链基因转录[27]。Pulkkinen等[28]研究显示,抑制肾癌细胞中miR-155水平可上调BACH1的表达水平,同时细胞的增殖和侵袭能力下降,凋亡水平增加。谷仕艳等[29]研究表明ATO可通过抑制miR-155的表达水平,激活BACH1蛋白,抑制 NQO1和 HO-1蛋白的表达,从而削弱细胞的总抗氧化能力,最终诱导细胞死亡。研究显示miR-155是BACH1表达水平的负调控因子,BACH1是其靶基因之一[27, 29-30],而本研究通过采用Targetscan和miRada均预测BACH1是gga-miR-155的靶基因,结合差异表达基因GO功能和KEGG信号通路富集分析,推测gga-miR-155可通过调控BACH1基因的表达而参与调控MDCC-MSB1的代谢过程,但其具体的功能还需进一步的验证。
本研究发现,转染gga-miR-155模拟物可导致MDCC-MSB1细胞中gga-miR-155的表达量显著增加,通过RNA-seq在gga-miR-155转染组与对照组细胞中共检测到87个差异表达基因,其主要与代谢和蛋白结合相关。综合分析发现,差异表达基因中的BACH1基因在gga-miR-155的作用下可能参与调控了MDCC-MSB1细胞中的代谢过程,可作为进一步功能验证的关键基因。
猜你喜欢肿瘤发生测序调控二代测序协助诊断AIDS合并马尔尼菲篮状菌脑膜炎1例传染病信息(2021年6期)2021-02-12microRNA与肿瘤发生关系的研究进展理论与创新(2020年9期)2020-07-14如何调控困意学苑创造·A版(2020年12期)2020-01-07经济稳中有进 调控托而不举中国外汇(2019年15期)2019-10-14基因测序技术研究进展科海故事博览·下旬刊(2019年6期)2019-04-16外显子组测序助力产前诊断胎儿骨骼发育不良中国生殖健康(2018年4期)2018-11-06Wnt信号通路调节小肠肿瘤发生实用肿瘤学杂志(2018年2期)2018-02-01顺势而导 灵活调控作文教学研究(2016年1期)2016-07-05SUMO修饰在细胞凋亡中的调控作用医学研究杂志(2015年8期)2015-06-22microRNA-95与肿瘤发生机制的研究医学研究杂志(2015年5期)2015-06-10栏目最新:
- 高校辅导员先进事迹心得范文优选4篇2024-05-08
- 行政管理专业介绍范文3篇2024-05-08
- 学校应对突发公共卫生事件应急预案范本6篇2024-05-08
- 党风廉政建设和反腐败工作学习心得体会...2024-05-08
- 红领巾奖章二星章人物事迹材料4篇2024-05-08
- 民主生活会对班子批评意见5篇2024-05-08
- 校学生会竞选演讲稿14篇2024-05-08
- 国庆演讲稿9篇2024-05-08
- 自强不息励志演讲稿3篇2024-05-08
- 2023年村干部廉政教育大会纪委书记讲话稿3篇2024-05-08
